- 05.04.2017 Pneumonie-Antibiotikum erfolgreich in Phase 3 … zum Artikel
- 04.10.2018 Ambulant erworbene bakterielle Lungenentzündung / akute Haut- und Hautstrukturinfektionen – FDA-Zulassung
Ambulant erworbene bakterielle Lungenentzündung / akute Haut- und Hautstrukturinfektionen – FDA-Zulassung
04.10.2018 Paratek Pharmaceuticals, Inc. gab heute bekannt, dass die U.S. Food and Drug Administration (FDA) Nuzyra (Omadacyclin) für die Behandlung von Erwachsenen mit ambulant erworbener bakterieller Lungenentzündung (CABP) und akuten Haut- und Hautstrukturinfektionen (ABSSSI) zugelassen hat.
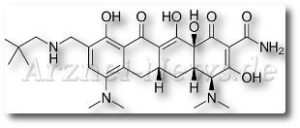 Nuzyra ist ein modernisiertes Tetracyclin und ein einmal täglich zu verabreichendes IV- und orales Antibiotikum, das eine Aktivität über ein breites Spektrum von Bakterien zeigt, einschließlich grampositiver, gramnegativer, atypischer und medikamentenresistenter Stämme, schreibt das Unternehmen.
Nuzyra ist ein modernisiertes Tetracyclin und ein einmal täglich zu verabreichendes IV- und orales Antibiotikum, das eine Aktivität über ein breites Spektrum von Bakterien zeigt, einschließlich grampositiver, gramnegativer, atypischer und medikamentenresistenter Stämme, schreibt das Unternehmen.
Die Zulassung des Medikaments wurde durch mehrere klinische Studien im Rahmen des globalen Entwicklungsprogramms des Unternehmens unterstützt. Fast 2.000 erwachsene Patienten erhielten Nuzyra, und es wurde festgestellt, dass es wirksam und allgemein sicher und gut verträglich ist.
Im Rahmen der Zulassung hat sich Paratek bereit erklärt, Post-Marketing-Studien in den Bereichen CABP und Pädiatrie durchzuführen.
© arznei-news.de – Quellenangabe: Paratek Pharmaceuticals
