Krebsbehandlung
Afatinib ist ein Protein-Kinase-Inhibitor mit dem ATC-Code L01XE13: Antineoplastische und immunmodulierende Substanzen. Handelsname ist Giotrif (Gilotrif in den USA). Das Medikament wird derzeit bei Lungenkrebs eingesetzt (ist in der Erprobungsphase für andere Krebsarten).
Infos
- News: Studien / Forschung; Zulassung
- Erfahrungen, Erfahrungsberichte
- Indikation / Anwendung / Krankheiten: Lungenkrebs
- Nebenwirkungen / unerwünschte Wirkungen / Verträglichkeit
- Wirkstoff / Wirkung / Wirkmechanismus / Wirkweise
- Wirksamkeit (s. bei entsprechenden Krankheiten / Studien)
- Chemische Struktur / Eigenschaften
- Hersteller bzw. Entwickler: Boehringer Ingelheim
- ATC Code: L01XE13
- Medikamentengruppe: Tyrosinkinase-Hemmer
News
- Afatinib: FDA Zulassung bei Lungenkrebs im Spätstadium
- Giotrif bei Lungenkrebs – EU Zulassungsempfehlung
- EU-Zulassung bei Lungenkarzinom
- 07.07.2015 Giotrif schlägt Tarceva bei Plattenepithelkarzinom der Lunge
- 17.08.2015 IQWiG: Hinweis auf zusätzlichen Nutzen bei bei bestimmten Mutationen
- 06.02.2016 Überlegenheit bei PFS gegenüber Gefitinib in NSCLC-Studie
- 27.02.2016 EMA-Empfehlung zur Erweiterung der Zulassung: Monotherapie für die Behandlung von lokal fortgeschrittenem oder metastasierendem NSCLC mit Plattenepithel-Histologie während oder nach Platin-basierter Chemotherapie.
- 07.04.2016 Neue EU-Lungenkrebs Indikation: Plattenepithelkarzinom
- 11.09.2016 Dosisanpassung verbessert Verträglichkeit bei EGFR+ NSCLC
- 12.10.2016 Vergleichsstudie zu Wirksamkeit und Sicherheit
- 18.01.2018 FDA: Erweiterung der Zulassung auf Erstlinientherapie von NSCLC mit EGFR-Mutationen
- 20.10.2018 NSCLC (EGFR+): Resultate aus Real-World-Studie mit Osimertinib als Nachbehandlung
Afatinib: FDA Zulassung bei Lungenkrebs im Spätstadium
Die U.S. Food and Drug Administration genehmigte heute Gilotrif (Wirkstoff Afatinib; in Europa Giotrif) für Patienten mit fortgeschrittenen (metastasiertem) nicht-kleinzelligen Lungenkrebs (NSCLC).
Die Tumoren sollen dabei spezifische Arten der epidermalen Wachstumsfaktor-Rezeptor (EGFR) Genmutation durch einen von der FDA genehmigten Test erkennen lassen.
Tyrosinkinase-Hemmer: Wirkstoff / Wirkung / Wirkmechanismus / Wirkweise
Gilotrif ist ein Tyrosinkinase-Hemmer, der Proteine blockiert, die die Entwicklung von krebsartigen Zellen fördern. Es ist für Patienten bestimmt, deren Tumore die EGFR Exon 19 Deletionen oder Exon 21 L858R Substitution Genmutationen zeigen. Gilotrif ist gleichzeitig mit dem Therascreen EGFR RGQ PCR Kit zugelassen worden, einem Begleitdiagnosetest, der feststellt, ob die Lungenkrebszellen eines Patienten die EGFR Mutationen aufweisen.
Sicherheit und Wirksamkeit von Afatinib
Die Sicherheit und Wirksamkeit von Afatinib wurden in einer klinischen Studie mit über 345 Teilnehmern mit metastasiertem NSCLC untersucht, deren Tumore EGFR Mutationen zeigten. Die Teilnehmer bekamen (zufällig) Afatinib oder bis zu sechs Zyklen der Chemotherapie Medikamente Pemetrexed und Cisplatin.
Teilnehmer, die Afatinib (Handelsname Gilotrif) erhielten, zeigten eine Verzögerung des Tumorwachstums (progressionsfreies Überleben) von 4,2 Monate gegenüber der Chemotherapie. Es gab jedoch keine statistisch bedeutende Differenz im Gesamtüberleben.
Nebenwirkungen von Giotrif
Häufige Nebenwirkungen von Giotrif sind:
- Diarrhö (Durchfall),
- Hautauschläge, die Akne ähneln, Dermatitis akneiform,
- trockene Haut,
- Paronychie,
- Juckreiz (Pruritus),
- Entzündung der Mundschleimhaut,
- verminderter Appetit,
- Stomatitis,
- Gewichtsverlust,
- Entzündungen der Harnblase (Zystitis),
- Nasenbluten,
- laufende Nase,
- Fieber,
- Augenentzündungen und
- niedriger Kaliumspiegel im Blut (Hypokaliämie).
Schwerwiegende Nebenwirkungen von Giotrif sind:
- Diarrhö, der zu Nierenversagen und schwere Dehydratation führen kann,
- schwere Hautausschläge,
- Lungenentzündung und
- Leber-Toxizität.
© arznei-news.de – Quelle: FDA, Juli 2013
Kein Abo! (Schon ab 1,67€ für den Monat)
Giotrif bei Lungenkrebs – EU Zulassungsempfehlung
Das Komitee für Humanarzneimittel der Europäischen Zulassungsbehörde empfiehlt Giotrif bei vorbehandelten erwachsenen Patienten mit lokal fortgeschrittenem oder metastasiertem nicht-kleinzelligem Lungenkrebs (NSCLC) mit aktivierter EGFR-Mutation zuzulassen.
Giotrif mit dem Wirkstoff Afatinib der Firma Boehringer Ingelheim International GmbH hat seinen Nutzen in einer Phase III Studie im Vergleich mit einer Chemotherapie gezeigt.
Afatinib ist bereits in den USA unter dem Namen Gilotrif zugelassen worden.
© arznei-news.de – Quelle: Europäische Arzneimittel-Agentur, Juli 2013
GIOTRIF: EU-Zulassung bei Lungenkarzinom
Afatinib: Boehringer Ingelheim verkündete, dass die Europäische Kommission die Zulassung für GIOTRIF® erteilt hat.
Chemische Strukturformel
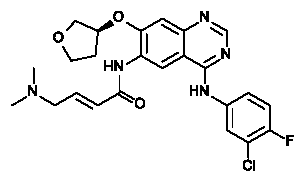
GIOTRIF (aktive Substanz Afatinib) wurde zugelassen für die Behandlung von erwachsenen Lungenkrebspatienten mit nicht-kleinzelligem Lungenkarzinom (NSCLC) und positivem EGFR-Mutationsstatus.
Afatinib wird in Europa unter dem Markennamen GIOTRIF® vermarktet und ist ein antitumoraler Wirkstoff aus der Gruppe der Kinasehemmer.
Nach den jüngsten Zulassungen in den USA (unter dem Handelsnamen GILOTRIF), Taiwan und Mexiko, basiert die EU-Zulassung von Afatinib auf Daten aus der zulassungsrelevanten LUX-Lung-III-Studie und anderen Phase-III und Phase-II Lungenkrebs-Studien.
Die häufigsten Nebenwirkungen in der Behandlung mit Afatinib/Giotrif waren:
Durchfall, Hautausschlag, trockene Haut, Appetitmangel und Entzündungen des Nagelbetts (Paronychie).
© arznei-news.de – Quelle: Boehringer Ingelheim, Sept. 2013
Giotrif schlägt Tarceva bei Plattenepithelkarzinom der Lunge
Boehringer Ingelheims Giotrif zeigt einen größeren Überlebensvorteil als Roches Tarceva bei zuvor behandelten Patienten mit fortgeschrittenem Plattenepithelkarzinom der Lunge.
Nach den in der Zeitschrift The Lancet Oncology veröffentlichten Daten der LUX-Lung 8-Studie zeigt der Wirkstoff Afatinib eine verlängerte Gesamtüberlebenszeit im Median von 7,9 Monaten im Vergleich zu 6,8 Monaten des Wirkstoffes Erlotinib, wodurch es zu einer Reduzierung des Sterberisikos um 19% kam.
Die Studie erreichte ihren primären Endpunkt und zeigte eine signifikante Verbesserung des progressionsfreien Überlebens gegenüber Tarceva, das eine genehmigte und empfohlene Behandlungsoption für fortgeschrittenes Plattenepithelkarzinom der Lunge nach der Behandlung mit First-Line-Chemotherapie auf Platinbasis ist.
Die Behandlungsmöglichkeiten bei dieser Form von Lungenkrebs sind begrenzt und der Krebs ist mit einer schlechten Prognose verbunden, wobei weniger als 5% der Patienten mit fortgeschrittenem SCC fünf Jahre oder mehr überleben, was die Notwendigkeit für neue Therapiemöglichkeiten betont.
Boehringer trifft auf Basis dieser Daten Vorbereitungen für die Zulassungsanträge für Giotrif als Behandlung bei fortgeschrittenem SCC; das Medikament wurde bereits auf verschiedenen Märkten für die Behandlung von EGFR-Mutation-positivem nicht-kleinzelligen Lungenkrebs freigegeben.
© arznei-news.de – Quelle: Boehringer, Juli 2015
IQWiG: Hinweis auf zusätzlichen Nutzen bei bei bestimmten Mutationen
17.08.2015 Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) konnte feststellen, dass Lungenkrebspatienten mit Mutation Del19 am stärksten profitieren würden. Dabei beruhe die aktuelle Bewertung auf einem neuen Datenschnitt der bereits 2014 untersuchten Studie zu Afatinib bei Lungenkrebs.
Es lagen jedoch nur für nicht vorbehandelte Patienten in relativ gutem Allgemeinzustand (ECOG-PS 0 oder 1) verwertbare Daten vor, sagt das IQWiG. Es stellte einen erheblichen Zusatznutzen bei Trägern der EGFR-Mutation Del19 und einen Anhaltspunkt für einen geringen Zusatznutzen von Giotrif bei Trägern der Mutation L858R fest.
Zur Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung) von Afatinib auf der Seite des IQWiG.
Überlegenheit bei PFS gegenüber Gefitinib in NSCLC-Studie
06.02.2016 Die Ergebnisse der LUX-Lung 7 Studie zeigen Überlegenheit beim progressionsfreien Überleben (PFS) und der Zeit bis zum Therapieversagen von Boehringer Ingelheims Gilotrif (USA) / Giotrif (EU) im Vergleich zu Iressa (Gefitinib) in der First-Line-Behandlung von Patienten mit fortgeschrittenem nicht-kleinzelligen Lungenkrebs (NSCLC) mit den EGFR-Mutationen del19 oder L858R.
Progressionsfreies Überleben
Die Phase-IIb-Studie erreichte zwei ihrer primären Endpunkte beim PFS und Zeit bis zum Therapieversagen (Zeit zwischen Beginn und Abbruch der Behandlung). Die Daten für den dritten co-primären Endpunkt – das Gesamtüberleben (OS) – sind noch nicht evaluiert und werden zu gegebener Zeit präsentiert.
Die Ergebnisse der LUX-Lung 7 Studie zeigen, dass Afatinib deutlich das Lungenkrebs-Progressionsrisiko um 27% gegenüber Gefitinib reduzierte. Die Verbesserung des PFS wurde im Laufe der Zeit deutlicher – mit einem deutlich höheren Anteil an noch lebenden und progressionsfreien Patienten nach 18 Monaten (27% vs. 15%) und 24 Monaten (18% vs. 8%).
Therapieversagen
Zusätzlich zum PFS verblieben die mit Giotrif behandelten Patienten eine deutlich längere Zeit in der Behandlung: Das Risiko für Therapieversagen war um 27% niedriger im Vergleich zu Iressa. Signifikant mehr Patienten erreichten mit Afatinib ein objektives Ansprechen des Tumors im Vergleich zu Gefitinib (70% vs. 56%) mit einer medianen Dauer des Ansprechens von 10,1 bzw. 8,4 Monaten.
Die Verbesserung des PFS konnte in den meisten vordefinierten klinischen Untergruppen erreicht werden, einschließlich Geschlecht, Alter, Rasse und EGFR-Mutationstyp.
Unerwünschte Arzneimittelwirkungen in LUX-Lung 7
Beobachtete Nebenwirkungen in der LUX-Lung 7 Studie waren den bekannten Sicherheitsprofilen beider Behandlungen ähnlich. Beide Medikamente wurden generell gut vertragen und es gab eine gleich niedrige Rate an behandlungsbedingten Abbrüchen in beiden Armen (6,3%). Die Gesamthäufigkeit schwerwiegender unerwünschter Arzneimittelwirkungen war für beide ähnlich.
© arznei-news.de – Quelle: Boehringer Ingelheim, Jan. 2016
FDA: Erweiterung der Zulassung auf Erstlinientherapie von NSCLC mit EGFR-Mutationen
18.01.2018 Die FDA hat einen ergänzenden Zulassungsantrag für Gilotrif zur Erstlinienbehandlung von Patienten mit metastasierendem nicht-kleinzelligen Lungenkrebs mit EGFR-Mutationen genehmigt.
Boehringer Ingelheim hat bekanntgegeben, dass die US-amerikanische Gesundheitsbehörde FDA (Food and Drug Administration) einen ergänzenden Zulassungsantrag für Gilotrif (Afatinib) für die Erstlinienbehandlung von Patienten mit metastasierendem nicht-kleinzelligen Lungenkrebs (NSCLC) genehmigt hat, deren Tumoren nicht-resistente Mutationen des epidermalen Wachstumsfaktorrezeptors (EGFR) aufweisen, die durch einen von der FDA zugelassenen Test nachgewiesen werden.
L861Q, G719X und S768I
Die neuen Fachinformationen enthalten Daten zu drei weiteren EGFR-Mutationen: L861Q, G719X und S768I. Die FDA hatte Afatinib bei der Bewertung dieses Antrags den Status einer Prioritätsprüfung zuerkannt.
Die sNDA-Zulassung basiert auf einer gepoolten Analyse von drei Studien aus dem klinischen Studienprogramm LUX-Lung (Phase II Studie LUX-Lung-2 und Phase III-Studien LUX-Lung-3 und LUX-Lung-6), in denen das Medikament bei NSCLC-Patienten untersucht wurde, deren Tumoren EGFR-Mutationen aufweisen, darunter L861Q, G719X oder S768I. Diese Analyse zeigte, dass Gilotrif bei diesen EGFR-Mutationen aktiv war, basierend auf objektiver Ansprechrate, Ansprechdauer, Krankheitskontrolle, progressionsfreiem Überleben und Gesamtüberleben.
Im Vergleich zu anderen EGFR-Mutationen sind L861Q-, G719X- oder S768I-Substitutionsmutationen mit einer schlechteren Prognose und eingeschränkten Behandlungsmöglichkeiten verbunden, schreibt Boehringer.
© arznei-news.de – Quelle: Boehringer Ingelheim, Jan. 2018
NSCLC (EGFR+): Resultate aus Real-World-Studie mit Osimertinib als Nachbehandlung
20.10.2018 Boehringer Ingelheim hat Ergebnisse aus GioTag bekanntgegeben, einer retrospektiven Real-World-Studie, in der die Wirkung einer Erstbehandlung mit Giotrif (Afatinib) gefolgt von Osimertinib bei Patienten mit epidermalem Wachstumsfaktor-Rezeptor-Mutation-positivem (EGFR M+) nicht-kleinzelligen Lungenkrebs (NSCLC) mit erworbenen T790M-Mutationen untersucht wurde, dem häufigsten Mechanismus der Resistenz gegen EGFR-Tyrosinkinase-Inhibitoren (TKI) der ersten und zweiten Generation.
Die Ergebnisse zeigten, dass die sequentielle Strategie wirksam bei der Aufschiebung der nachfolgenden Chemotherapiebehandlung war laut der in der Zeitschrift Future Oncology veröffentlichten Studie.
Laut Boehringer Ingelheim betrug die mediane Behandlungszeit für die aufeinander folgende Behandlung mit Afatinib und Osimertinib 27,6 Monate. In dieser breiten, praxisnahen Bevölkerungsgruppe war der klinische Nutzen über alle Patientengruppen hinweg konsistent, wobei besonders ermutigende Ergebnisse bei Patienten mit Exon-19-Deletion (Del19) positiver Erkrankung (mediane Zeit in der Behandlung 30,3 Monate) und asiatischen Patienten (mediane Zeit in der Behandlung 46,7 Monate) erzielt wurden. Zusätzlich lagen die Raten für das Gesamtüberleben (OS) für 2 Jahre und 2,5 Jahre bei 78,9% bzw. 68,8%.
Von den in dieser Studie befindlichen Patienten hatten 15,3% zu Beginn der Giotrif-Behandlung einen schlechten Performancestatus (definiert durch den ECOG-Leistungsstatus ≥2), der sie in der Regel von klinischen Studien ausschloss.
Während Osimertinib eine effektive Erstlinienbehandlung ist, mangelt es an zugelassenen nachfolgenden TKI-Behandlungsoptionen, und viele Patienten wechseln nach dem Osimertinib-Versagen zur Chemotherapie.
Die Ergebnisse deuten darauf hin, dass die sequentielle Strategie von Giotrif und Osimertinib einer erheblichen Anzahl von Patienten einen nachhaltigen klinischen Nutzen bieten könnte, da sie die chemotherapiefreie Behandlungsdauer verlängert.
© arznei-news.de – Quellenangabe: Boehringer Ingelheim; Future Oncology – doi:10.2217/fon-2018-0711
Schreiben Sie uns >> hier << über Ihre Erfahrungen und lesen Sie die Erfahrungsberichte / Kommentare zu diesem Medikament.
